引言:
名人患癌逝世,让我们再次感受到病魔的无情和残酷。同时,也再度引发了大众对于癌症的关注和讨论。其中,小细胞肺癌因其恶性程度高、预后差而成为大众热议的焦点。
尽管目前已拥有先进的医疗技术和丰富的医疗资源,但面对小细胞肺癌,即便是拥有巨额财富和崇高地位的名人,也常常会束手无策。这不禁让人好奇,小细胞肺癌究竟是一种怎样的疾病?为何如此凶险难治?
1:小细胞肺癌,为何如此凶残?
肺癌是中国和全球范围内发病率和病死率较高的恶性肿瘤,按照病理分型,可以分为两大类,非小细胞肺癌和小细胞肺癌。
其中小细胞肺癌约占肺癌总数的15%,根据国家癌症中心发布的癌症调查数据,2022年新发现小细胞肺癌人数约为16万人。[1]虽然小细胞肺癌的患病率低于非小细胞肺癌,但却“恶名昭著”。
·恶名何来?
小细胞肺癌患者可能会经历一系列的症状,如咳嗽、呼吸困难、胸痛、咯血等,这些症状会随着病情的进展而逐渐加重。相比非小细胞肺癌来说,小细胞肺癌分化程度低、恶性程度更高、生长速度更快、转移更早、扩散更快,而且大多数小细胞肺癌患者在诊断时已出现远处转移。
从出现症状到确诊,“机会窗口期”很短。有数据显示,小细胞肺癌患者中位生存时间仅8-13个月,五年生存率仅为6.8%。[2] 这对患者来说更是一场灾难,治疗上必须争分夺秒。
·烟草下的阴影!
注意,几乎所有的小细胞肺癌患者都有长期吸烟史。小细胞肺癌发病与吸烟极为密切,罹患小细胞肺癌的患者仅有2%从不吸烟[3]。
此外,长期处于含有石棉、焦油、含氡、铍等物质的环境,或长时间暴露在电离辐射、大气污染中,以及频繁接触二手烟等,也会大大增加罹患肺癌的概率。
·小细胞肺癌,真的没救了吗?
小细胞肺癌的预后与分期有着密切关系,因此在介绍小细胞肺癌的治疗及预后之前,首先来了解下小细胞肺癌的分期。
国内一般会采用美国癌症联合委员会(AJCC)TNM分期方法与VALG二期分期法相结合[4]对小细胞肺癌进行分期,分为局限期小细胞肺癌(LS-SCLC)和广泛期小细胞肺癌(ES-SCLC)。
可以简单理解为,“局限期”病灶比较集中,通过放疗或放化疗能够显著防止病情进一步恶化;而“广泛期”则属于晚期,病灶已经向全身转移,治疗难度更大,仅靠单纯放疗的意义不大,更多是要靠全身药物治疗控制病情。
具体定义为:
局限期小细胞肺癌
Ⅰ~Ⅲ期(任何T,任何N,M0),可以使用患者能耐受的根治性的放疗剂量。排除T3~4由于肺部多发结节或者肿瘤/结节体积过大而不能被包含在一个可耐受的放疗计划中。
广泛期小细胞肺癌
Ⅳ期(任何T,任何N,M1),或者T3-4由于肺部多发结节或者肿瘤/结节体积过大而不能被包含在一个可耐受的放疗计划中。
小贴士:
“T”是单词“Tumor”的简称,代表肿瘤,根据肿瘤的大小和对局部组织的影响程度,依次可用T1到T4来表示;
“N”是单词“Node”的简称,代表淋巴结,用“N0”表示没有淋巴结转移,根据淋巴结转移的严重程度,依次用“N1、N2、N3”表示;
“M”是“Metastasis”,代表远处转移,用“M0”表示没有出现远处转移的情况;如果发生了远处转移,则用“M1”表示。
临床医生通常采用多种检查手段来协助诊断小细胞肺癌,包括影像学检查如胸部增强CT、腹部增强CT、腹部B超、颈部淋巴结B超、头颅增强MRI,或者PET-CT。但确诊的金标准,依然是通过肺穿刺活检或支气管镜活检,病理检测后确认。
2:挑战、机遇与希望并存:小细胞肺癌治疗策略一览
·一线治疗仍以系统治疗和放疗为主
根据《2023CSCO小细胞肺癌诊疗指南》[5],目前小细胞肺癌的治疗手段主要包括手术、放疗、化疗和免疫治疗。
局限期小细胞肺癌的治疗手段相对会多一些,患者可以进行手术、胸部放疗、脑预防性照射及化疗等治疗,这些治疗互相组合后能够有效延长患者生存期。
局限期小细胞肺癌一线治疗方案

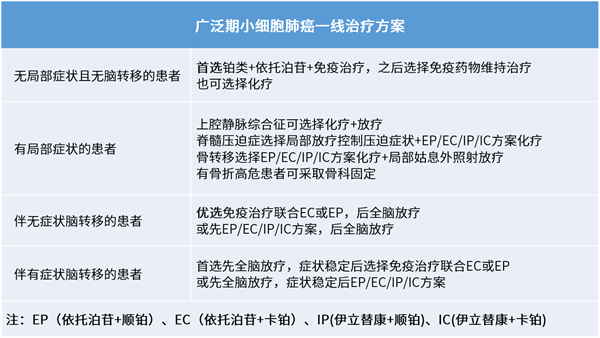
广泛期小细胞肺癌一线治疗方案
广泛期小细胞肺癌疾病进展严重,生存期比局限期小细胞肺癌更低,治疗相对更难。
长期以来,铂类化疗一直是广泛期小细胞肺癌的标准一线治疗方案。胸部放疗可降低胸内复发的风险并促进免疫应答。广泛期小细胞肺癌在治疗初期对放化疗敏感,但有效时间持续较短,很快会发生局部复发或远处转移。近年来,随着免疫治疗的飞速发展,免疫联合化疗已取代化疗成为目前优选的一线标准治疗方案。
·小细胞肺癌的后续治疗
复发后的小细胞肺癌,可选择的治疗相对还会更少一些。
二线治疗的小细胞肺癌,如>6个月复发,可选用原方案;如<6个月复发,首选拓扑替康,或参加临床试验。[5]
三线及以上治疗, CSCO小细胞肺癌指南[5] I级推荐用药为安罗替尼。该药目前已在国内获批广泛期小细胞肺癌三线治疗适应症。研究显示,安罗替尼将小细胞肺癌患者的中位PFS延长了3.4个月(4.1个月vs.0.7个月),疾病进展风险降低了81%,OS也延长了2.4个月。[6]

3:突破生存期,贝莫苏拜单抗助力抗击小细胞肺癌
对于广泛期小细胞肺癌患者,一线治疗选择具有至关重要的作用。一线免疫联合化疗的模式为患者带来了更多选择,将患者的生存获益提升2-4.5个月,总生存期在12.3-15.4个月[7]。而在2023年9月的世界肺癌大会上,贝莫苏拜单抗+安罗替尼+依托泊苷+卡铂四药联合方案的出现,标志着又一次的重大突破,为患者带来了更多可能和希望。
贝莫苏拜单抗是一种新型全人源化PD-L1单抗,它通过直接作用于肿瘤细胞的表面的PD-L1受体,阻止肿瘤细胞产生免疫逃逸的情况,重新激活免疫细胞对于肿瘤的杀伤作用 [8]。安罗替尼是小分子多靶点酪氨酸激酶抑制剂,能够抑制肿瘤血管生成及调节肿瘤免疫微环境,通过联合PD-1/PD-L1单抗促进抗肿瘤免疫反应[9],来达到治疗肿瘤的效果。而依托泊苷和卡铂作为化疗药物,可以直接破坏肿瘤细胞的DNA,阻断其生长和繁殖。这样的联合方案对肿瘤实现了多方位的强力攻击。
在2023年世界肺癌大会(WCLC)上,ETER701研究结果显示[10]:相比对照组,贝莫苏拜单抗+安罗替尼+依托泊苷+卡铂四药联合方案组的客观缓解率从66.8%提升到了81.3%,中位无进展生存期延长了2.72个月(6.93vs4.21个月),中位总生存期更是大幅提升了7.43个月,达到惊人的19.32个月(数据截止时间: 2022/5/14),大大刷新了既往广泛期小细胞肺癌的生存数据!
同样值得肯定的是,四药联合方案整体不良反应可管可控,患者耐受良好。
这些令人振奋的研究结果,为广大广泛期小细胞肺癌患者带来了更多长期生存的希望。目前该联合方案的上市申请已经被国家药监部门受理,期待贝莫苏拜单抗早日上市,为更多患者提供治疗新选择!
注:本文中提及的治疗方法、研究成果以及“突破生存期”等相关描述均基于截至2024年4月的信息和研究数据,本文提供的信息旨在增进对小细胞肺癌治疗现状的理解,不应被视为医疗建议或指导。在采取任何治疗措施之前,建议咨询专业医疗人员以获得适合个人状况的建议。
参考文献:
[1] 郑荣寿, 陈茹, 韩冰峰, 等. 2022年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2024, 46(3): 221-231.
[2] Giordano Fabricio Cittolin-Santos, et al. Cancer. 2024 Mar 12. doi: 10.1002/cncr.35281.
[3] Rudin CM, et al. Nat Rev Dis Primers. 2021 Jan 14; 7(1): 3.
[4] KALEMKERIAN GP, GADGEEL SM. Modern staging of small cell lung cancer. J Natl Compr Canc Netw, 2013, 11 (1): 99-104.
[5]中国临床肿瘤学会(CSCO)小细胞肺癌诊疗指南2023.
[6] CHENGY, WANGQ, LIK, et al. Br J Cancer, 2021, 125(3): 366-371.
[7] W Jeffrey Petty et al. JAMA Oncol. 2023 Mar 1; 9(3): 419-429.
[8] Boussiotis VA. et al. N Engl J Med 2016; 375: 1767-78.
[9] Su Y, et al. [A Case Report of Advanced Lung Adenocarcinoma Harboring KRAS Mutation Treated with Anlotinib]. Zhongguo Fei Ai Za Zhi. 2018 May 20; 21(5): 428-430.
[10]ChengY, et al. WCLC 2023. OA01. 03.


