
近日,易文赛研究院药物研发团队在期刊《Journal of Cellular Biochemistry》发表研究论文“Umbilical cord MSC‐derived exosomes improve alveolarmacrophage function and reduce LPS‐induced acute lung injury”,论文聚焦分析脐带间充质干细胞(UCMSC)来源的外泌体(Exosomes)在脂多糖诱导的急性肺损伤模型中的治疗作用及其机制,探索其临床转化潜力。

急性肺损伤(ALI) 是一种可经多种感染因素如细菌、病毒感染和非感染性因素如吸入毒性气体、大量输血、药物中毒、急性胰腺炎等引起的肺部肺泡上皮细胞和毛细血管内皮细胞损伤的呼吸系统重症。这种损伤导致肺血管通透性增加,进而引起弥漫性肺间质和肺泡水肿。如果不及时治疗,ALI可发展为更严重的急性呼吸窘迫综合征 (ARDS)。目前,尚无具体的ALI/ARDS药物治疗方案,最常通过氧疗、机械通气和控制肺部炎症和液体积聚的药物缓解患者症状。
现已有大量临床研究探讨利用间充质干细胞作为COVID‐19引起的肺损伤的潜在治疗方法。间充质干细胞(Mesenchymal stem cells,MSCs) 作为 ALI和其他肺病的可能治疗方法,在临床前和临床研究中显示了极具前景的治疗效果。
易文赛研发团队通过分析UCMSC来源Exosomes在脂多糖 (LPS)诱导的ALI模型中的作用机制,发现UCMSC来源的Exosomes(UCMSC-EXO)可有效改善肺泡巨噬细胞的代谢功能,并促进其向抗炎表型的转变,最终改善ALI。
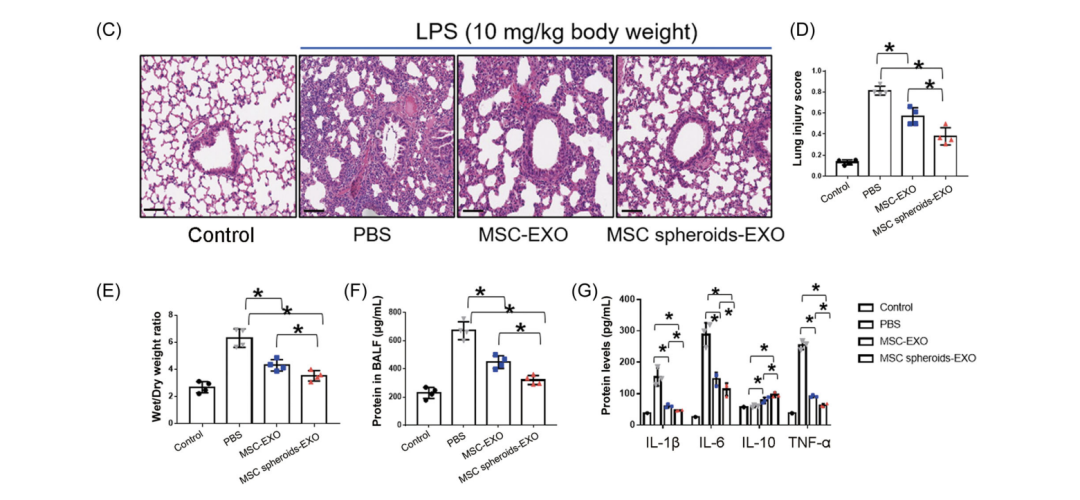
研究结果显示,UCMSC-EXO治疗可显著抑制ALI小鼠内皮和上皮通透性增加(p<0.05),肺损伤显著下降,具体表现为炎性细胞浸润减少、肺泡壁变薄;而干细胞做3D微球培养后得到的外泌体对肺损伤的修复能力更强(图2C,D)。同时,两个外泌体处理组也显著抑制了肺湿/干比值(图2E),并表现为与肺损伤评分降低、炎性细胞浸润减少、支气管肺泡灌洗液 (BALF)中的蛋白渗漏减少(图2F)。此外,外泌体处理显著降低炎性细胞因子白细胞介素(IL)-1β、IL‐6和肿瘤坏死因子(TNF)‐α的表达,而IL‐10水平升高(图2G)。
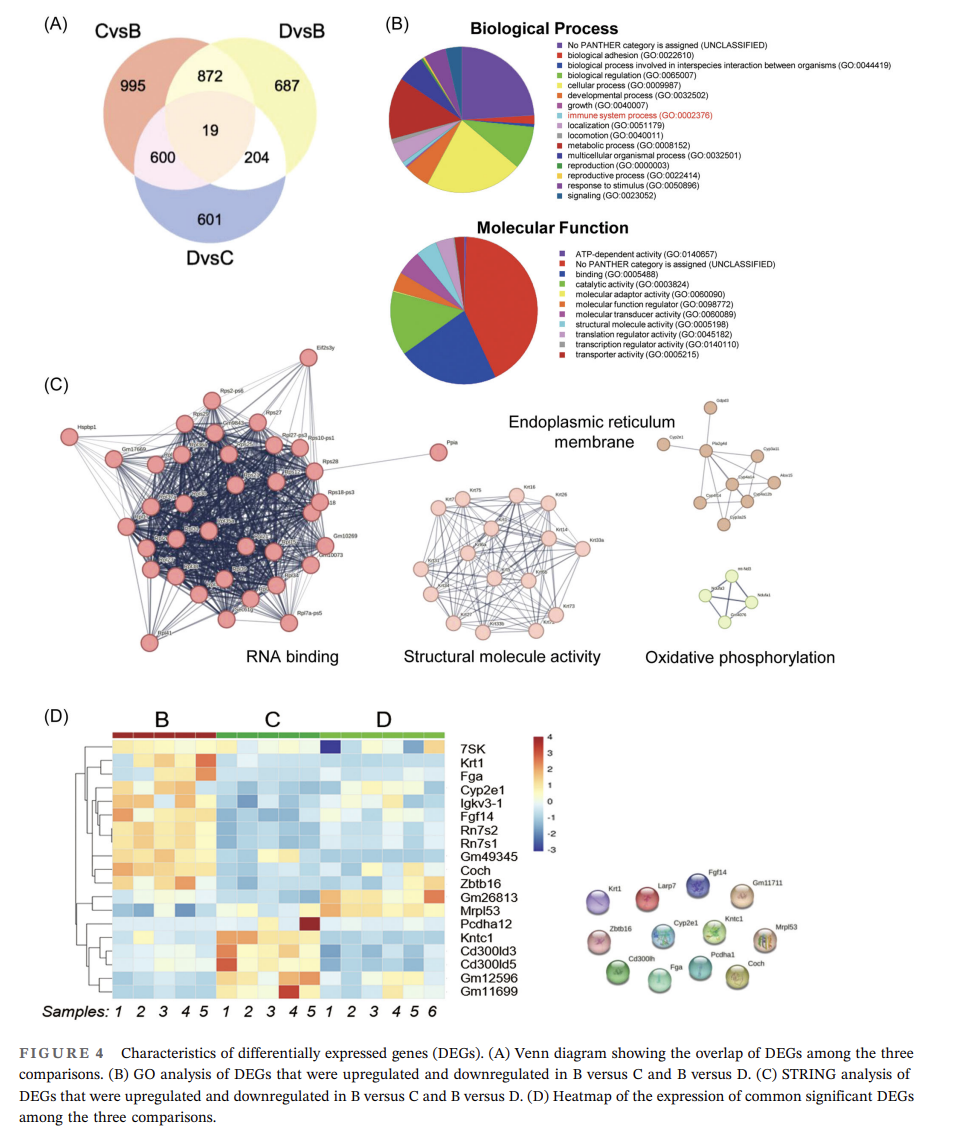
进一步RNA-seq分析结果表明,各组间显著差异表达基因(DEGs)从生物学过程角度看,主要富集在生物粘附、细胞过程和生物调控中;从分子功能角度看,DEGs主要富集在结合和催化活性上;STRING 分析表明,这些蛋白富集在 RNA 结合、结构分子活性、内质网膜和氧化磷酸化中(图4C)。此外,研究得到12个显著DEGs:Larp7、Gm11711、Coch、Kntc1、Cd300lh、Fga、Pcdha1、Cyp2e1、Fgf14、Krt1、Zbtb16、Mrpl53(图4D),均被证实与巨噬细胞极化相关。
(*巨噬细胞极化:当机体内环境稳态遭到破坏时,巨噬细胞通过吞噬、释放炎症因子等作用清除外源微生物,以恢复机体动态平衡,这个过程称为活化。伴随着活化,在细胞因子的作用下,巨噬细胞改变其表型,以增强应对微环境变化的能力,这个过程即为巨噬细胞的极化。巨噬细胞极化就是指成熟巨噬细胞在特殊微环境刺激下,产生不同功能表型的过程。巨噬细胞的极化对防御病原体、调节炎症、修复组织和维持体内平衡的稳定有着十分重要的作用。)
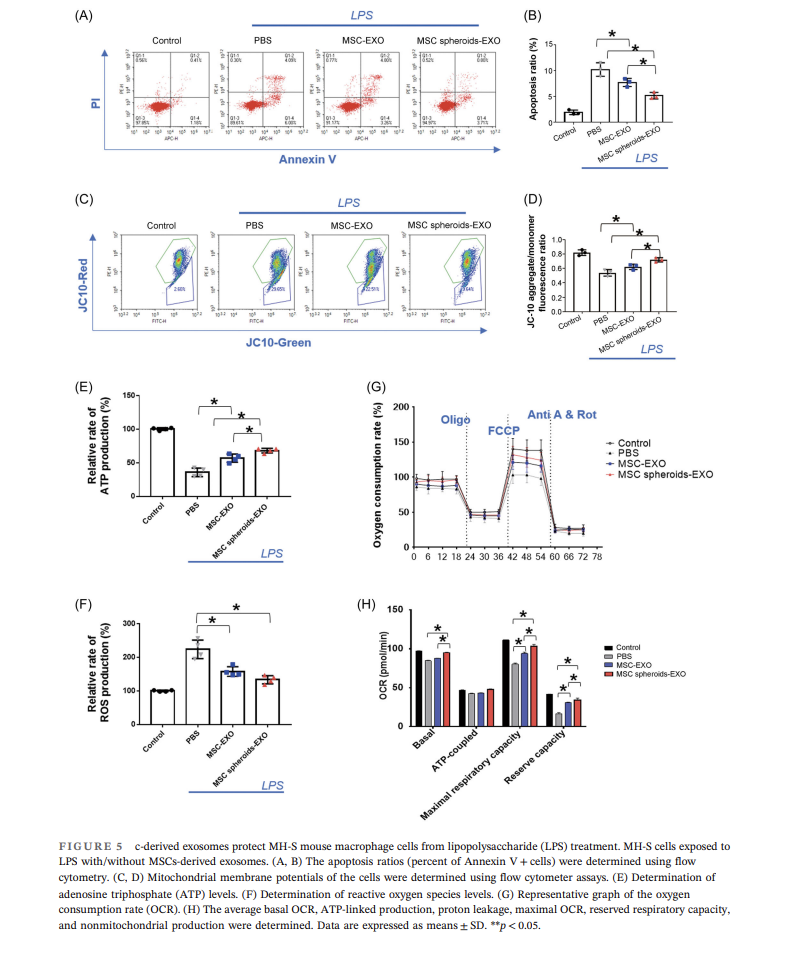
进一步研究显示UCMSC-EXO能够在体外条件下更好地保护巨噬细胞:UCMSC-EXO能够降低巨噬细胞凋亡水平,提高线粒体膜电位,促进ATP生成,并降低ROS水平,且3D培养UCMSC所得外泌体效果更为显著,上述结果可能是通过调控巨噬细胞能量代谢实现的(图5)。
综上,研究数据充分证明了UCMSC来源的外泌体在严重肺部炎症进程中的抗炎和组织保护作用,3D培养UCMSC EXO给药效果更为明显。尽管利用MSC来源的外泌体进行疾病治疗的研究仍处于早期阶段,还需要更多研究来了解其潜在优势与作用机制。不可否认,其已成为干细胞研究领域的新热点,在未来疾病治疗和组织修复应用中极具潜力。


